 歡迎來到北京博奧森生物技術(shù)有限公司網(wǎng)站!
歡迎來到北京博奧森生物技術(shù)有限公司網(wǎng)站! 歡迎來到北京博奧森生物技術(shù)有限公司網(wǎng)站!
歡迎來到北京博奧森生物技術(shù)有限公司網(wǎng)站!


發(fā)表期刊:Bioactive Materials
IF:20.3
一作單位:華南理工大學(xué)
研究背景
在骨缺損修復(fù)過程中,受損部位會經(jīng)歷細(xì)胞募集、血管重建和新骨形成等一系列生物學(xué)過程。生物活性玻璃(bioactive glass, BG) 是一類能釋放功能性離子、參與血管生成與成骨過程的生物材料,可通過釋放功能性離子在血管生成與成骨過程中發(fā)揮關(guān)鍵作用。銅摻雜生物活性玻璃(CuBG) 能釋放包括Cu2+、Ca2+和SiO?4-在內(nèi)的多種離子,這些離子對組織再生具有促進(jìn)作用。其中,Cu2+通過抑制缺氧誘導(dǎo)因子1α(HIF-1α) 在細(xì)胞核內(nèi)與核外的降解來模擬缺氧效應(yīng),從而激活HIF-1信號通路,進(jìn)一步上調(diào)血管內(nèi)皮生長因子(VEGF) 和內(nèi)皮型一氧化氮合酶(eNOS) 的表達(dá),增強(qiáng)血管生成能力。此外,CuBG還能激活多種成骨相關(guān)信號通路,如MAPK、Wnt/β-連環(huán)蛋白和BMP-Smad通路等,富集細(xì)胞內(nèi)成骨相關(guān)的miRNA,協(xié)同促進(jìn)骨缺損修復(fù)。然而,在早期階段,離子的快速釋放會導(dǎo)致離子濃度升高和堿性增強(qiáng),從而引發(fā)劇烈疼痛、溶血反應(yīng)及過度炎癥反應(yīng),最終阻礙骨再生進(jìn)程。
源自骨髓間充質(zhì)干細(xì)胞(BMSCs) 的小型胞外囊泡(sEVs) 被認(rèn)為是一種安全有效的生物制劑,這些囊泡可被遠(yuǎn)端細(xì)胞攝取,并顯著調(diào)節(jié)其功能與行為。sEVs不僅能夠保留源細(xì)胞的優(yōu)勢特性,還能避免其潛在缺陷;同時其分子信號具有歸巢效應(yīng)、循環(huán)穩(wěn)定性以及非免疫原性等特點,可有效募集細(xì)胞并促進(jìn)組織修復(fù)。然而,在骨缺損條件下,BMSCs來源的sEVs存在產(chǎn)量有限、促血管生成與成骨能力不足等問題,嚴(yán)重限制了其在臨床治療中的應(yīng)用。
本研究采用CuBG處理BMSCs,制備出小型胞外囊泡(sEVs),并將其類比為“納米振動激發(fā)器"(nano-vibration exciter)。通過激活HIF-1信號通路及其介導(dǎo)的自噬過程,將CuBG釋放的離子信號轉(zhuǎn)化為生化因子信號,從而更高效地發(fā)揮BG的成骨潛能,驅(qū)動組織的再生與修復(fù)。
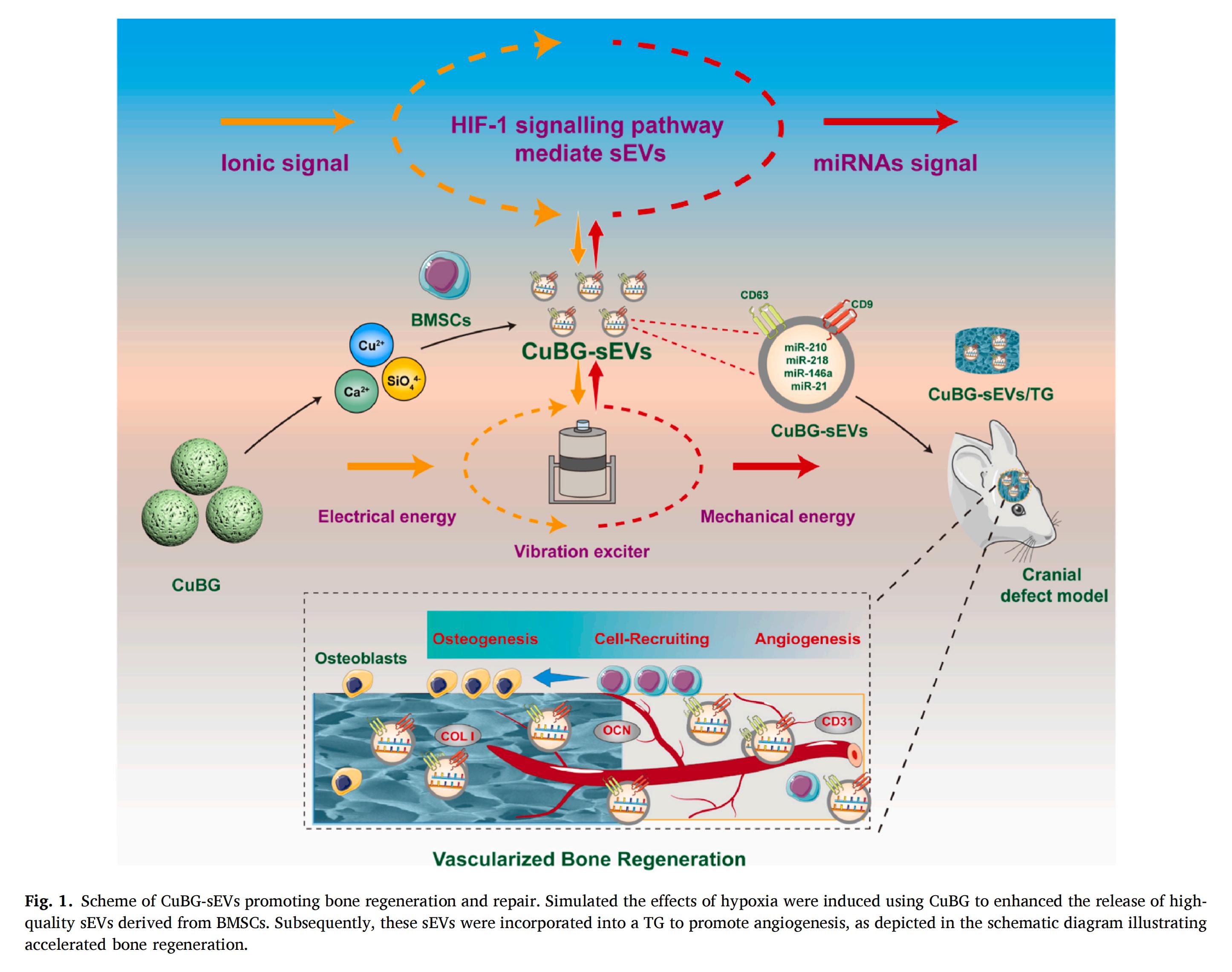
實驗結(jié)果
1.sEVs的提取和表征
BG(60SiO2-36CaO-4P2O5) 和CuBG(60SiO2-34CaO-2CuO-4P2O5) 納米顆粒均呈現(xiàn)球形結(jié)構(gòu),具有非晶相結(jié)構(gòu)特征,平均粒徑分別為467.31 nm和307.48 nm。CuBG具有良好的生物相容性,在作用于BMSCs后未引起sEVs粒徑或形態(tài)的顯著改變,避免了傳統(tǒng)缺氧培養(yǎng)方法可能引發(fā)的細(xì)胞凋亡等副作用。CuBG釋放的Cu2+通過抑制細(xì)胞核外羥化酶(PHD) 對脯氨酸殘基的羥化作用,阻斷細(xì)胞核內(nèi)缺氧誘導(dǎo)因子抑制因子1(FIH-1) 的活性,從而抑制HIF-1α的降解,穩(wěn)定HIF-1α蛋白。
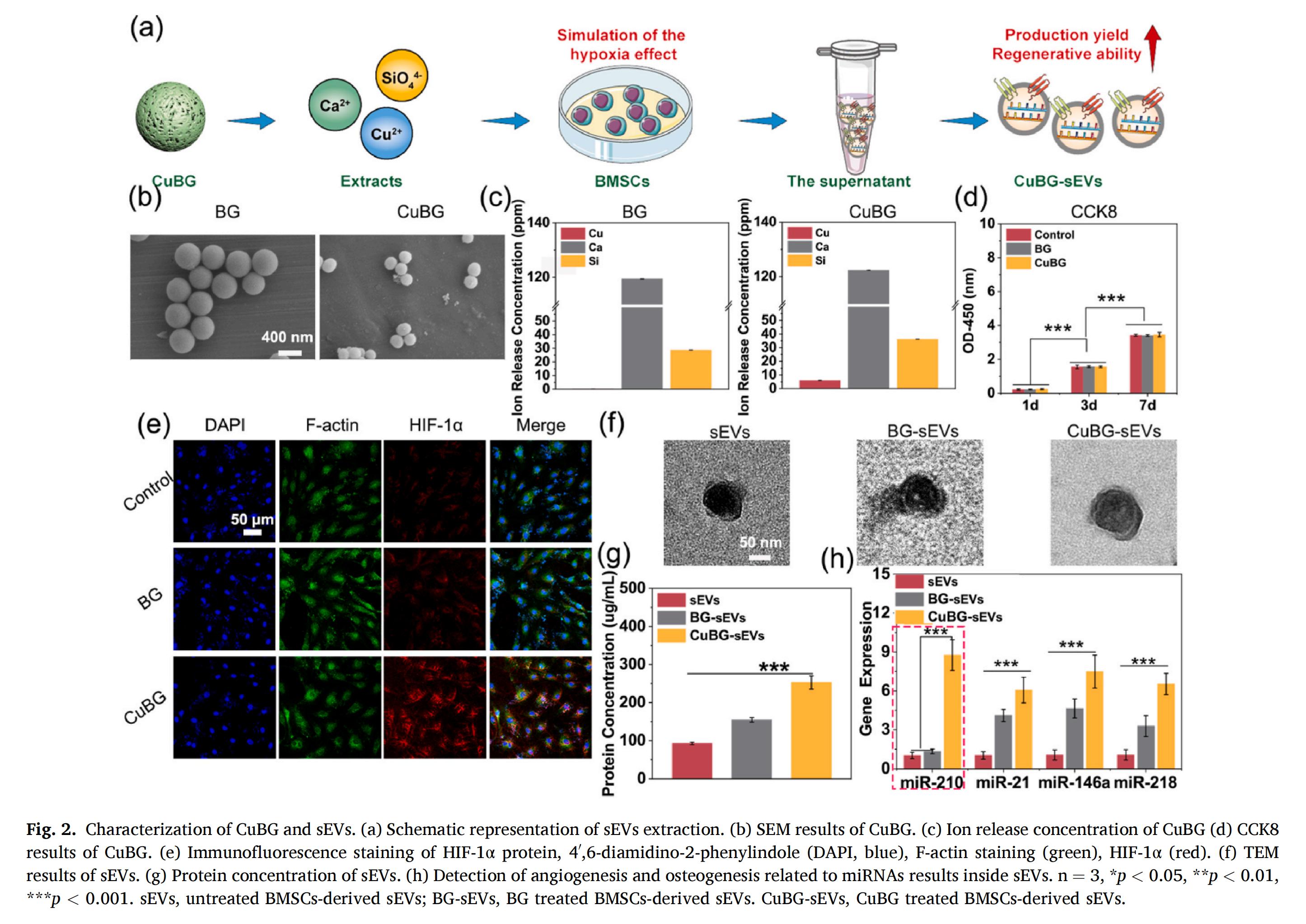
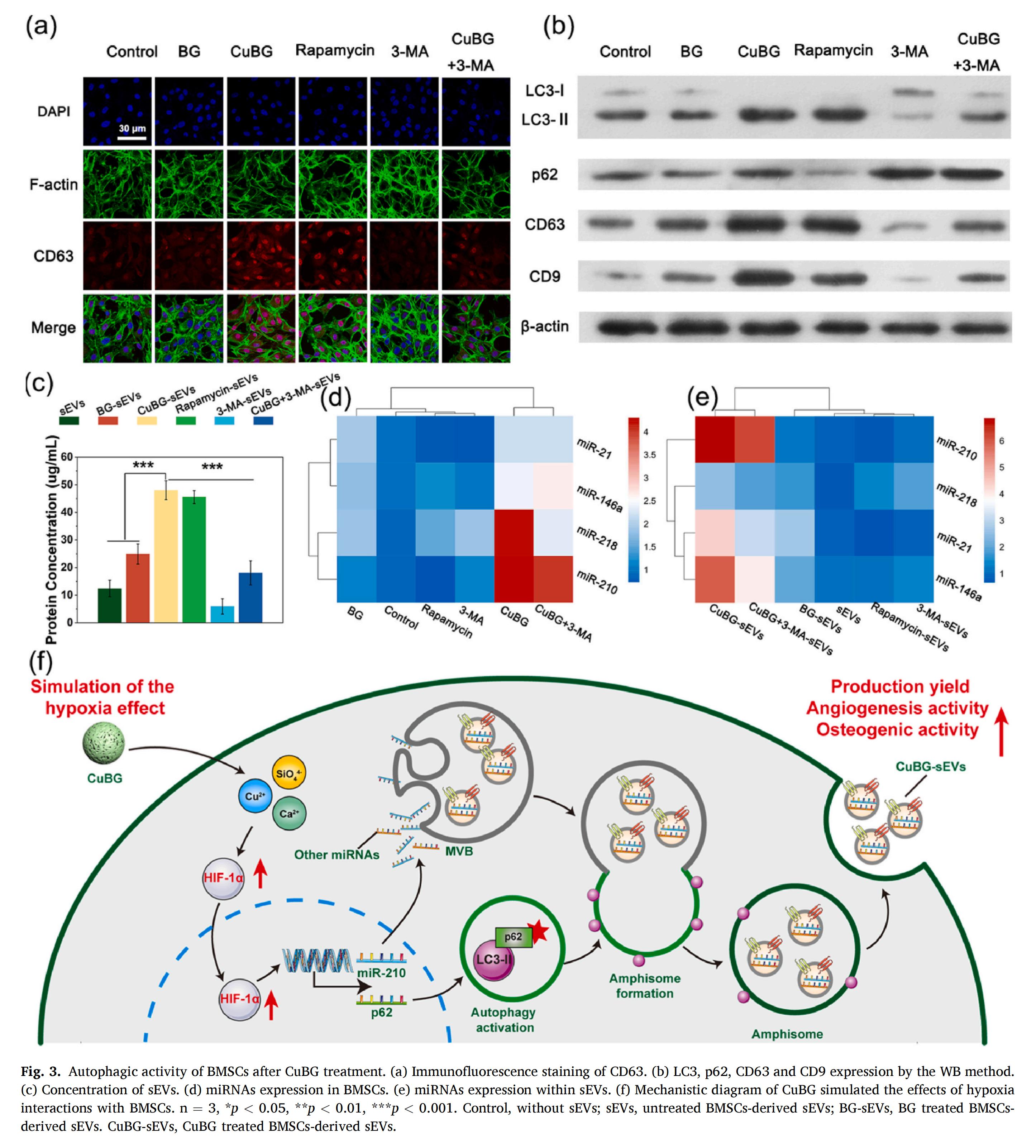
2.CuBG-sEVs增強(qiáng)成骨活性的機(jī)制
CuBG能釋放Cu2+、Ca2+和SiO?4-等多種促進(jìn)組織再生的離子,其中,Cu2+通過抑制HIF-1α在細(xì)胞核內(nèi)和核外的降解過程來模擬缺氧效應(yīng),從而激活HIF-1信號通路,并上調(diào)促血管生成miRNA的表達(dá),特別是miR-210。在缺氧條件下,HIF-1α?xí)M(jìn)入細(xì)胞核,激活自噬相關(guān)基因,如微管相關(guān)蛋白1輕鏈3(LC3) 和beclin1,并誘導(dǎo)p62蛋白表達(dá),從而調(diào)控自噬進(jìn)程并增強(qiáng)sEVs的生成。此外,CuBG釋放的Ca2+和SiO?4-等其他活性離子,也能夠促進(jìn)成骨相關(guān)miRNA的富集,如miR-218、miR-146a和miR-21。綜上所述,CuBG以HIF-1信號通路及其介導(dǎo)的自噬激活作為核心調(diào)控機(jī)制,有效提升了CuBG-sEVs的產(chǎn)量并增強(qiáng)其成骨活性。
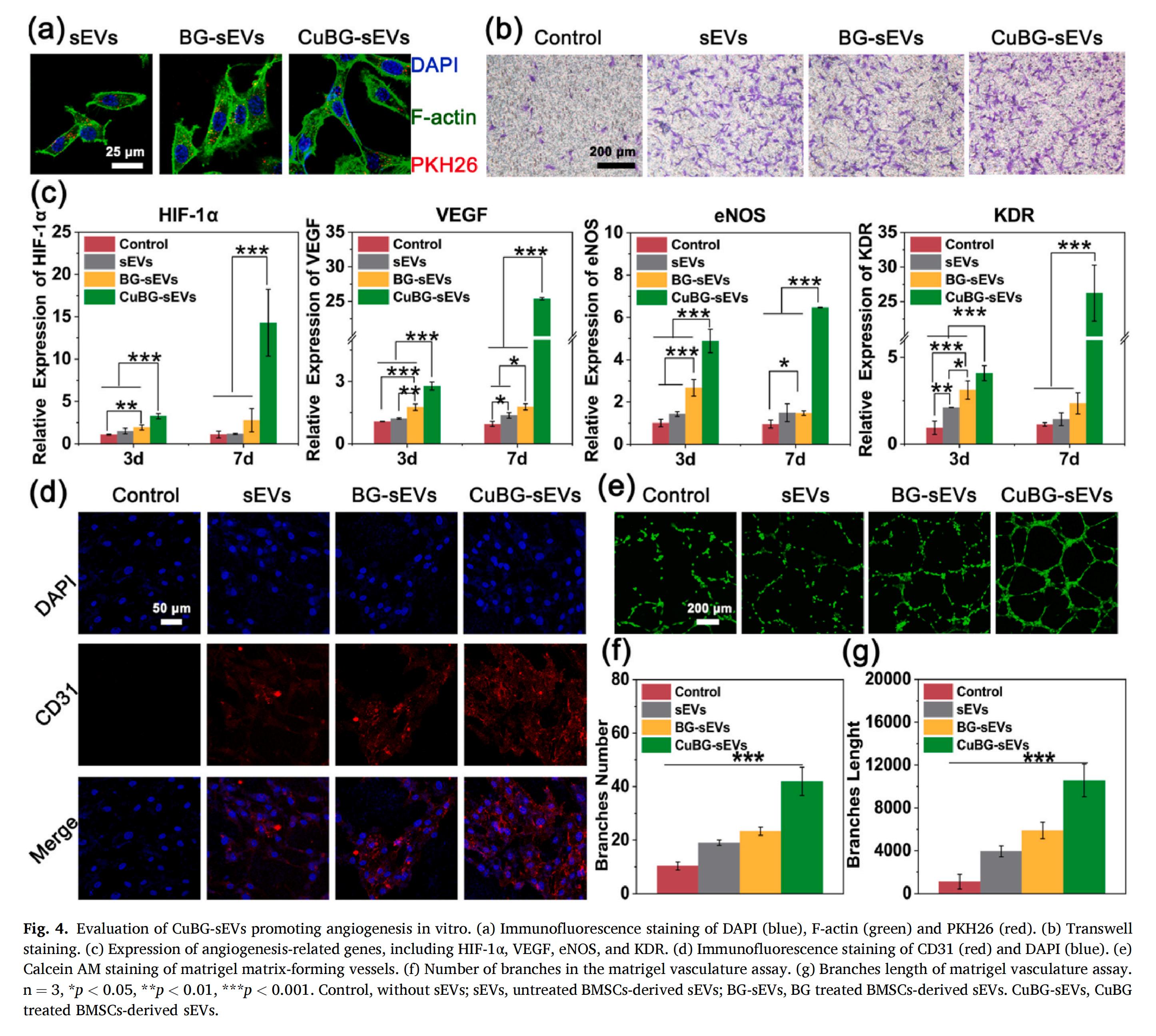
3.體外血管生成與骨形成
血管生成在骨形成過程中發(fā)揮著關(guān)鍵作用,能夠輸送組織再生必需的營養(yǎng)素、礦物質(zhì)、生長因子和氧氣。人臍靜脈內(nèi)皮細(xì)胞(HUVECs) 能夠有效攝取sEVs,進(jìn)而促進(jìn)血管的生成。CuBG-sEVs可被HUVECs有效內(nèi)化,并顯著刺激其遷移能力,顯示出在細(xì)胞間通訊的重要潛力。此外,CuBG-sEVs表現(xiàn)出更強(qiáng)的細(xì)胞募集能力,這可能與其上調(diào)miR-210表達(dá)水平有關(guān)。在miR-210調(diào)控的HIF-1α信號通路激活后,可促進(jìn)VEGF的釋放,進(jìn)而誘導(dǎo)趨化因子SDF-1的表達(dá),最終增強(qiáng)細(xì)胞募集過程。
此外,CuBG-sEVs能夠有效上調(diào)包括VEGF、激酶插入結(jié)構(gòu)域受體(KDR)、eNOS以及血小板內(nèi)皮細(xì)胞黏附分子(CD31) 在內(nèi)的多個血管生成關(guān)鍵基因的表達(dá)。在該調(diào)控作用下,細(xì)胞間連接性顯著增強(qiáng),并形成了典型的管狀結(jié)構(gòu),新生血管數(shù)量與血管長度顯著增加,充分證明了CuBG-sEVs在促進(jìn)血管生成方面的顯著效能。
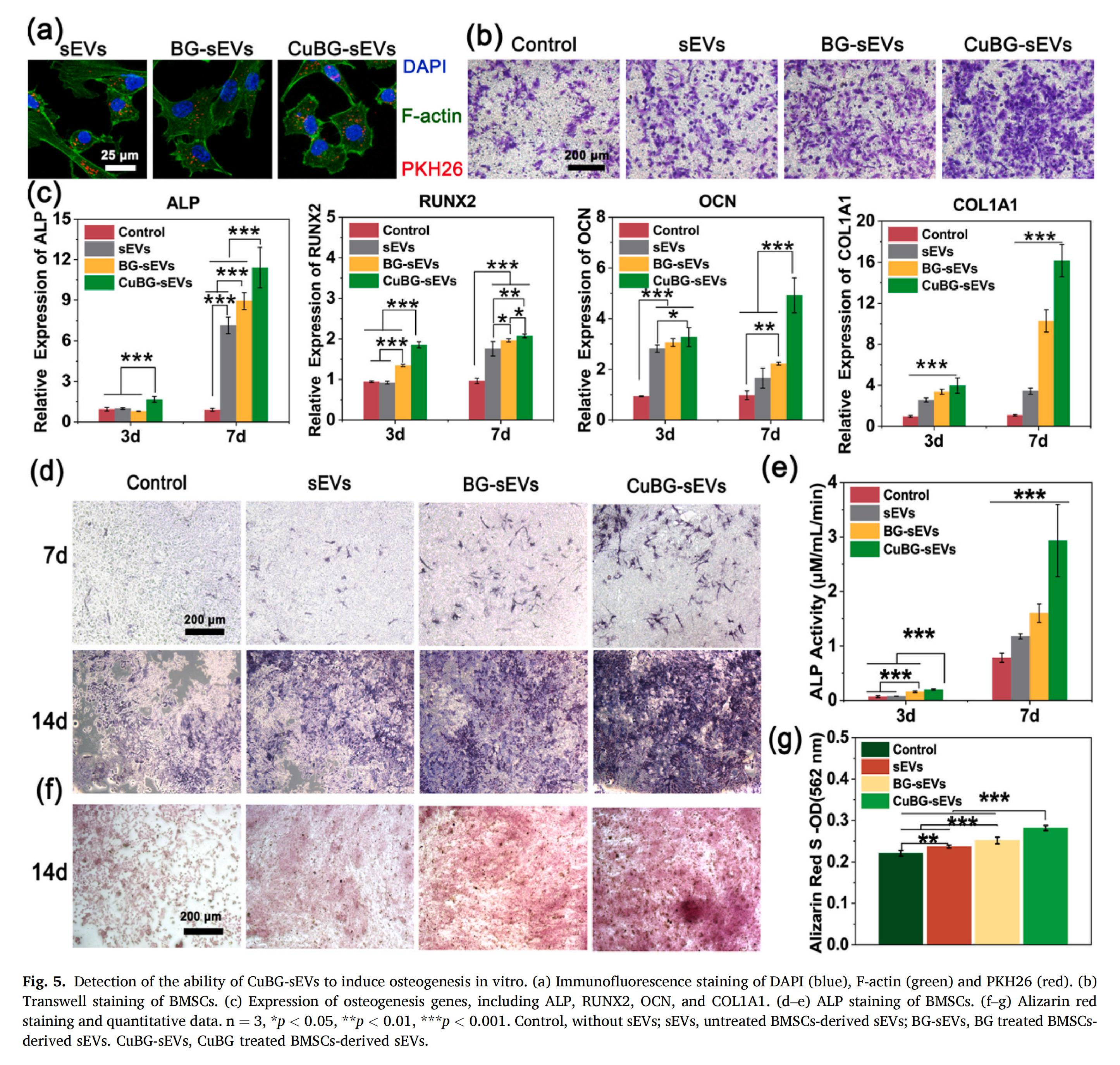
原代間充質(zhì)干細(xì)胞(MSCs) 的募集及其成骨分化在骨再生過程中具有關(guān)鍵作用。CuBG-sEVs富含多種與成骨相關(guān)的miRNA,如miR-218、miR-146a和miR-21,表現(xiàn)出顯著的成骨潛力。經(jīng)CuBG-sEVs處理后,多個成骨相關(guān)基因的表達(dá)均顯著上調(diào),包括堿性磷酸酶(ALP)、runt相關(guān)轉(zhuǎn)錄因子(RUNX2)、骨鈣素(OCN)、骨形態(tài)發(fā)生蛋白2(BMP2) 和I型膠原α1(COL1A1) 等。其中,ALP和RUNX2的上調(diào)在骨基質(zhì)合成與礦化初期階段起著關(guān)鍵作用,而礦化基質(zhì)含量的增加進(jìn)一步促進(jìn)了成骨進(jìn)程。
CuBG-sEVs中的miRNA不僅可以通過調(diào)控Wnt/β-連環(huán)蛋白、PI3K/Akt和MAPK信號通路誘導(dǎo)BMSCs向成骨分化,更能精準(zhǔn)靶向調(diào)控該過程的關(guān)鍵靶點,這種多層面的調(diào)控機(jī)制,充分印證了CuBG-sEVs作為CuBG優(yōu)質(zhì)替代品的應(yīng)用價值。
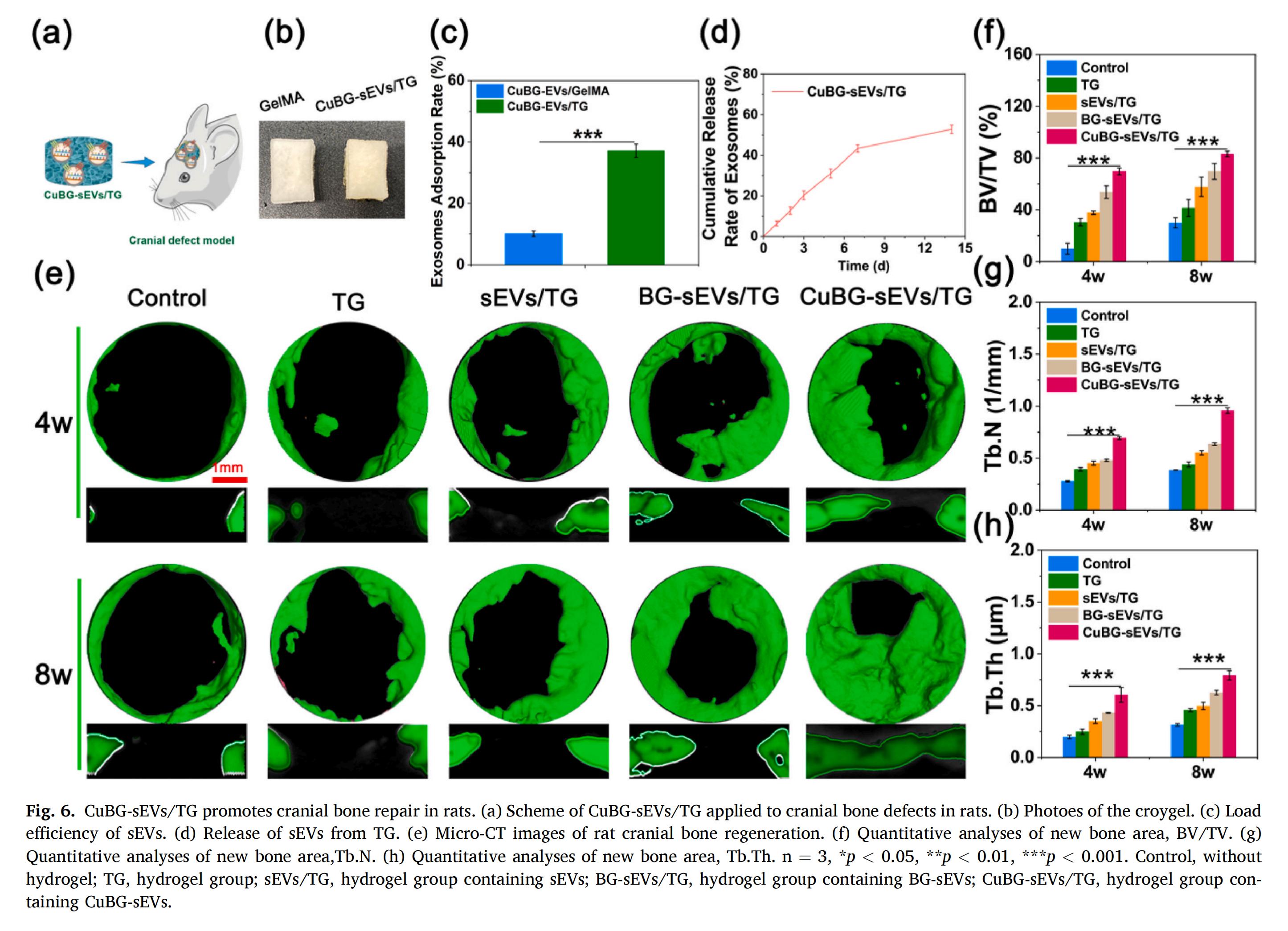
4.體內(nèi)血管生成與骨形成
作為遞送載體使用的單寧酸包被明膠甲基丙烯酰基冷凍凝膠(TG),展現(xiàn)出優(yōu)異的生物相容性、機(jī)械性能和大孔結(jié)構(gòu)。基于這些特性,它能高效吸附自噬體,并能實現(xiàn)對藥物釋放動力學(xué)的精準(zhǔn)調(diào)控。
通過在大鼠顱骨臨界缺損模型中的評估證實,CuBG-sEVs/TG能更有效地促進(jìn)新骨形成。其療效具體表現(xiàn)為骨體積分?jǐn)?shù)(BV/TV)、骨小梁數(shù)量(Tb.N)和骨小梁厚度(Tb.Th) 的同步顯著增加,凸顯了CuBG-sEVs/TG在骨修復(fù)面積與骨再生質(zhì)量兩方面的全面優(yōu)勢。
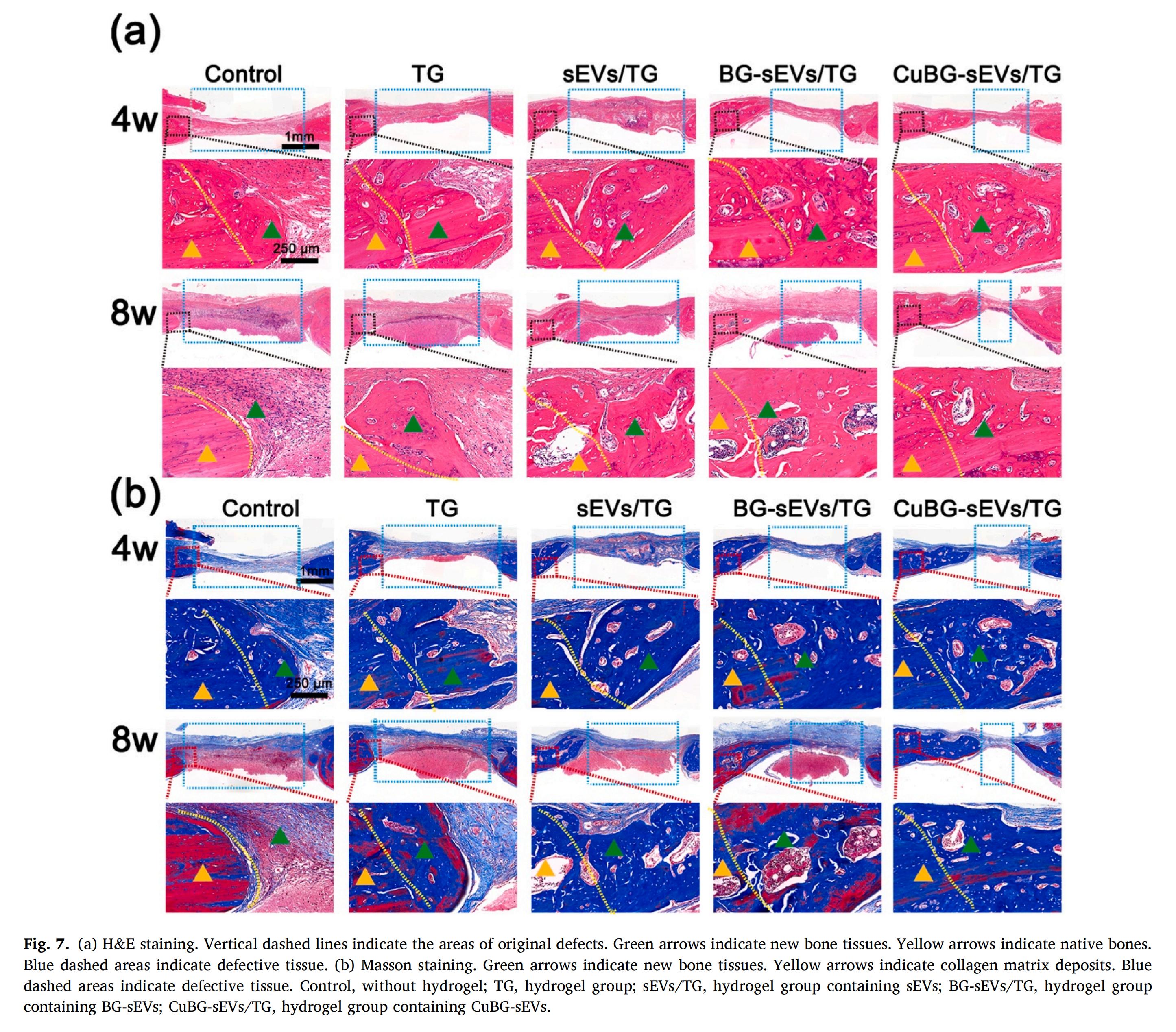
CuBG-sEVs/TG引發(fā)了有序的骨愈合過程:缺損區(qū)快速形成連續(xù)新骨并向中心延伸,同時伴隨細(xì)胞外基質(zhì)的顯著沉積與膠原纖維的致密化、成熟化。這充分證明了高活性CuBG-sEVs的持續(xù)釋放能高效促成高質(zhì)量骨再生。
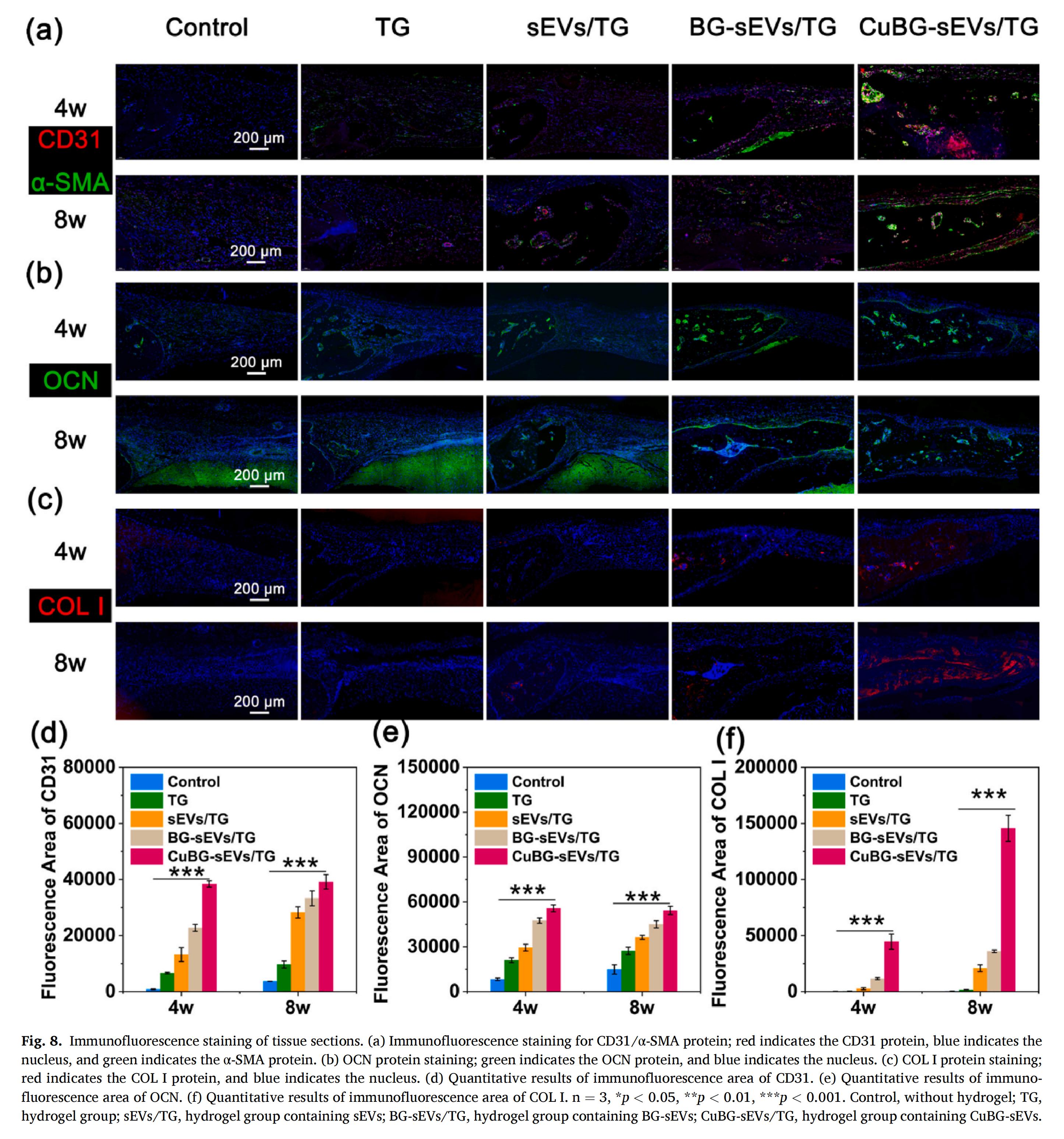
CuBG-sEVs通過miR-210調(diào)控KDR/VEGF/eNOS信號軸,顯著上調(diào)了血管關(guān)鍵蛋白CD31的表達(dá),從而驅(qū)動HUVECs的粘附與聚集,有效促進(jìn)了血管生成。所形成的血管網(wǎng)絡(luò)為骨再生提供了必要的營養(yǎng)支持,其與成骨過程在時空上的高度耦合,表明CuBG-sEVs/TG通過促血管生成為成骨奠定了堅實的微環(huán)境基礎(chǔ)。
CuBG-sEVs通過其中的miRNA(如miR-218、miR-146a和miR-21) 上調(diào)OCN表達(dá)以激活與成骨相關(guān)的信號通路;同時,引導(dǎo)骨基質(zhì)的關(guān)鍵成分I型膠原形成有序、與內(nèi)源性新骨強(qiáng)互聯(lián)的結(jié)構(gòu)框架,有效支持細(xì)胞遷移、定植及新骨的支持和保護(hù)。這兩方面協(xié)同作用,共同強(qiáng)化了骨再生過程。
結(jié)論
本研究開發(fā)了的納米振動激發(fā)器CuBG-sEVs,通過HIF-1信號通路將CuBG的離子信號高效轉(zhuǎn)化為miRNA信號,激活自噬過程,顯著提升CuBG-sEVs產(chǎn)量。由此產(chǎn)生的CuBG-sEVs能被HUVECs和BMSCs快速內(nèi)化,通過富集的miRNA發(fā)揮招募細(xì)胞、促進(jìn)血管生成與成骨分化的雙重效應(yīng)。
此外,將CuBG-sEVs與TG冷凍凝膠聯(lián)合應(yīng)用于骨缺損部位,CuBG-sEVs通過驅(qū)動細(xì)胞募集、血管生成與成骨分化這一核心機(jī)制,有效支持骨缺損的全面再生;該過程伴隨著加速血管生成與增強(qiáng)I型膠原沉積,從而顯著提高了修復(fù)效率。此項工作證實了sEVs作為BG替代方案的巨大潛力,為提升骨再生療效提供了新思路。
